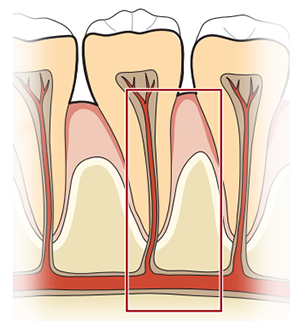
口腔黏膜免疫问题与牙齿健康
粘膜组织时刻暴露于各种环境刺激之中,其特异性免疫反应的微调控是维持组织稳态的关键。但是粘膜组织屏障的免疫学具体机制还尚不清楚。在人体中,先天性纤溶酶原(Plasminogen,PLG)缺乏会导致严重的粘膜炎症相关疾病,比如口腔粘膜相关的牙周炎等,这说明纤溶酶在粘膜的免疫稳态中发挥着关键性作用。为此,美国国立卫生研究院Niki M. Moutsopoulos研究组与Thomas H. Bugge研究组合作在Science发文题为Fibrin is a critical regulator of neutrophil effector function at the oral mucosal barrier,揭开了口腔环境中调节屏障以及作用分子机制。

PLG是由肝脏合成的,其在血液循环过程中浓度很高。PLG是一种酶原,通过酶原激活剂转化为具有活性的酶。人类中PLG基因纯合或者多种杂合突变会导致严重的粘膜疾病,因此说明该基因子在粘膜中发挥关键作用。这些病人会在多种粘膜部位出现纤维蛋白的沉积,并导致严重牙周炎、角膜炎、肠炎等【1,2】。牙周炎会导致牙齿松动、钝痛、牙龈出血等病理现象。纤维蛋白是PLG的靶点,它本身是一种促炎因子,许多与PLG缺乏相关异常炎症反应都与持续的血管外纤维蛋白沉积有关。口腔黏膜中,PLG缺乏会导致牙齿周围软组织和骨骼组织中纤维蛋白的沉积【3】。为了揭开粘膜中纤维蛋白沉积和免疫病理之间的联系,作者们构建并采用了一系列相关的基因工程小鼠模型。
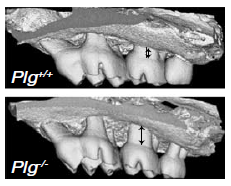
PLG基因敲除的小鼠表型与PLG缺乏的病人相似,出现与粘膜相关的免疫病理表现包括牙周炎、结肠炎以及胃肠问题等【4,5】。牙周炎的标志是黏膜炎症和牙齿周围的骨破坏。与野生型以及同窝的杂合型小鼠相比,PLG基因敲除的小鼠在12周龄的时候出现牙周骨丢失,并且在更为年老的24周龄时牙周骨丢失更加严重。PLG激活因子双敲除后与PLG敲除的表型类似。为了进一步确认PLG在小鼠牙周炎中的作用,作者们构建了一个PLG的催化活性突变型的小鼠,该小鼠与PLG缺失的表型类似,也会造成牙周骨的丢失,并且牙周炎的成因是纤维蛋白的沉积。这些结果确认PLG在小鼠中的缺失与人类疾病相似,会导致严重的口腔粘膜免疫病理并且与纤维蛋白的异常沉积相关。
进一步地,为了确认纤维蛋白的累积是否是牙周炎的触发因素,作者们构建了PLG以及纤维蛋白FGA的双突变小鼠。作者们发现纤维蛋白的同时缺失会挽救由PLG缺失所导致的牙周骨病理情况。另外,作者们还发现口腔中的微生物会进一步地促进PLG缺失造成的牙周炎。
随后,作者们希望揭开纤维蛋白介导的口腔粘膜免疫病理的具体分子机制。通过无偏向性RNA-seq,作者们对同窝的野生型以及PLG缺失小鼠中的转录组变化进行了检测,基因本体论分析发现PLG缺失型小鼠中与中性粒细胞迁移、炎症反应、细胞外基质分解、细胞因子信号转导、白细胞迁移和对细菌分子的应激响应等分子信号通路中的基因发生了显著上调。进一步地,作者们使用流式细胞仪对牙龈炎症浸润物进行检测,发现PLG缺失型小鼠中性粒细胞出现了显著增加,而其他免疫细胞则没有出现显著的变化。这说明PLG缺乏的小鼠中口腔粘膜的免疫病理可能是由中性粒细胞介导的。
随后,作者们通过对纤维蛋白基因中骨髓细胞整合素结合结构域的突变发现纤维蛋白沉积异常造成的牙周骨缺失主要由这一基序所介导,并且纤维蛋白是通过整合素调节中性粒细胞效应因子功能的,因为此种整合素对于中性粒细胞的粘附非常关键。除此之外,作者们通过对人群中PLG基因中多态性分析发现,很多位点的突变与口腔粘膜相关疾病相关,而且对放线共生放线杆菌以及牙龈卟啉单胞菌等多种病原体敏感性会更高。因此,PLG位点的遗传变异与严重的或者潜在的人类牙周炎疾病有关。

图1 工作模型
总的来说,该工作发现纤维蛋白是口腔粘膜屏障稳态的重要免疫调节因子,并由中性粒细胞参与并激活所介导,为纤维蛋白在中性粒细胞活化和口腔粘膜免疫中的作用提供了见解,同时也为治疗人类牙周疾病提供了新的见解(图1)。
据统计,我国人均寿命将突破80岁,随着年龄增长牙齿以及口腔粘膜的健康会逐渐出现问题,“吃嘛嘛香”是确保老年时期具有较高的生活质量的关键之一。另外“牙疼不是病,疼起来要命”,因此对口腔健康越来越成为从年轻人到老年人所共同关注点。该工作对于通过建立小鼠模型,提出了纤维蛋白作为物理节点帮助中性粒细胞在口腔黏膜正确的时间、正确的地点发挥作用的具体分子机制,为此作为同期亮点刊发了推荐文章题为Fibrin sparks inflammation in the oral mucosa。关注牙齿健康,有你有我!
原文链接:
https://doi.org/10.1126/science.abl5450
参考文献
1 Tefs, K. et al. Molecular and clinical spectrum of type I plasminogen deficiency: A series of 50 patients. Blood 108, 3021-3026, doi:10.1182/blood-2006-04-017350 (2006).
2 Schuster, V., Hügle, B. & Tefs, K. Plasminogen deficiency. Journal of thrombosis and haemostasis : JTH 5, 2315-2322, doi:10.1111/j.1538-7836.2007.02776.x (2007).
3 Kurtulus Waschulewski, I. et al. Immunohistochemical analysis of the gingiva with periodontitis of type I plasminogen deficiency compared to gingiva with gingivitis and periodontitis and healthy gingiva. Archives of oral biology 72, 75-86, doi:10.1016/j.archoralbio.2016.07.013 (2016).
4 Bugge, T. H., Flick, M. J., Daugherty, C. C. & Degen, J. L. Plasminogen deficiency causes severe thrombosis but is compatible with development and reproduction. Genes & development 9, 794-807, doi:10.1101/gad.9.7.794 (1995).
5 Bugge, T. H. et al. Loss of fibrinogen rescues mice from the pleiotropic effects of plasminogen deficiency. Cell 87, 709-719, doi:10.1016/s0092-8674(00)81390-2 (1996).













